1. LA BIOFISICA.
LA FORMACIÓN DEL UNIVERSO Y EL ORIGEN DE LA VIDA

La Biofísica es una sub-disciplina de la Biología que estudia los
principios físicos subyacentes a todos los procesos de los sistemas vivientes.
La biofísica
es una ciencia reduccionista porque
establece que todos los fenómenos observados en la naturaleza tienen una
explicación científica predecible.
Ramas de la Biofísica
·
Biomecánica: Estudia la mecánica del movimiento en los seres
vivientes; por ejemplo, la locomoción, el vuelo, la natación, el equilibrio
anatómico, la mecánica de los fluidos corporales, la fabricación de prótesis
móviles, etc.
·
Bioelectricidad: Estudia los procesos electromagnéticos y
electroquímicos que ocurren en los organismos vivientes así como también los
efectos de los procesos electromagnéticos abióticos sobre los seres vivientes;
por ejemplo, la transmisión de los impulsos neuroeléctricos, el intercambio
iónico a través de las biomembranas, la generación biológica de electricidad
(anguilas, rayas, etc.), la aplicación de la electrónica en biomedicina, etc.
·
Bioenergética (termodinámica
biológica): Se dedica al
estudio de las transformaciones de la energía que ocurren en los sistemas
vivientes; por ejemplo, la captura de energía por los biosistemas, la
transferencia de energía desde y hacia el entorno del biosistema, el
almacenamiento de energía en la célula, etc.
·
Bioacústica: Investiga y aplica la transmisión, captación y
emisión de ondas sonoras por los biosistemas.
·
Biofotónica: Estudia las interacciones de los biosistemas con
los fotones; por ejemplo, la visión, la fotosíntesis, etc.
·
Radiobiología: Estudia los efectos biológicos de la radiación
ionizante y la no ionizante y sus aplicaciones en las técnicas biológicas de
campo y de laboratorio.
El origen del universo
La teoría más conocida sobre el origen del universo se centra en un cataclismo cósmico sin igual en la historia: el big bang. Esta teoría surgió de la observación del alejamiento a gran velocidad de otras galaxias respecto a la nuestra en todas direcciones, como si hubieran sido repelidas por una antigua fuerza explosiva.
La teoría más conocida sobre el origen del universo se centra en un cataclismo cósmico sin igual en la historia: el big bang. Esta teoría surgió de la observación del alejamiento a gran velocidad de otras galaxias respecto a la nuestra en todas direcciones, como si hubieran sido repelidas por una antigua fuerza explosiva.
Antes del big bang, según los científicos, la inmensidad del universo
observable, incluida toda su materia y radiación, estaba comprimida en una masa
densa y caliente a tan solo unos pocos milímetros de distancia. Este
estado casi incomprensible se especula que existió tan sólo una fracción del
primer segundo de tiempo.
Los defensores del big bang sugieren que hace unos 10.000 o 20.000
millones de años, una onda expansiva masiva permitió que toda la energía y
materia conocidas del universo (incluso el espacio y el tiempo) surgieran a
partir de algún tipo de energía desconocido.
La teoría mantiene que, en un instante (una trillonésima parte de un
segundo) tras el big bang, el universo se expandió con una velocidad
incomprensible desde su origen del tamaño de un guijarro a un alcance
astronómico. La expansión aparentemente ha continuado, pero mucho más despacio,
durante los siguientes miles de millones de años.
Los científicos no pueden saber con exactitud el modo en que el universo
evolucionó tras el big bang. Muchos creen que, a medida que transcurría el
tiempo y la materia se enfriaba, comenzaron a formarse tipos de átomos más
diversos, y que estos finalmente se condensaron en las estrellas y galaxias de
nuestro universo presente.
2.
LA BIOFÍSICA Y LA MEDICINA MODERNA. LA
CIENCIA: MÉTODO CIENTÍFICO
La
Biofísica ha hecho grandes aportes a la Medicina. El conocimiento Biofísico ha
sido el pilar fundamental para el entendimiento de los fenómenos fisiológicos
que son base del funcionamiento del organismo humano en estado normal y
patológico. Dentro de ellos podemos mencionar: la recepción de señales
exteriores por parte del organismo, la transmisión del impulso nervioso, los
procesos biomecánicos del equilibrio y desplazamiento del organismo humano, la
óptica geométrica del ojo, la transmisión del sonido hasta el oído interno y el
cerebro, la mecánica de la circulación sanguínea, de la respiración pulmonar,
el proceso de alimentación y sostenimiento energético del organismo, el
mecanismo de acción de las moléculas biológicamente funcionales sobre las
estructuras celulares (las membranas, los organoides bioenergéticos, los
sistemas mecano-químicos), los modelos físico-matemáticos de los procesos
biológicos, etc.
De
otro lado, el establecimiento de las bases biofísicas de los fenómenos arriba
mencionados ha sido básico para el desarrollo de dispositivos técnicos,
aparatos y medidores para obtener bioinformación, equipos de autometría y
telemetría; que permiten un diagnóstico médico más efectivo y confiable.
En
la actualidad el desarrollo de la Medicina depende en gran medida de su
capacidad tecnológica, la cual está determinada por el desarrollo del
conocimiento biofísico soporte de la Bioingeniería.
Cuando
hablamos de biofísica, el término bio refleja su principal objetivo: la
vida. Según argumentaba el premio Nobel de Fisiología y Medicina de 1965,
Jacques Monod, en su célebre ensayo El azar y la necesidad: aunque la
biología desempeña un papel marginal en cuanto a que estudia el mundo viviente,
y es éste sólo una parte ínfima del universo conocido, también tiene un papel
central si admitimos que la ciencia tiene como objetivo último entender la relación
del hombre con el universo. La física podría entenderse como un enfoque o arma
para resolver enigmas en las ciencias de la vida. ¿Pero qué aporta en realidad?
Michel Daune (Universidad de Estrasburgo) en la introducción de su
libro Biofísica molecular afirmaba que, en primera instancia, la
física ha caracterizado el desarrollo de nuevos métodos de investigación. Y, en
segundo lugar, más que ninguna otra disciplina, ha
proporcionado leyes que son universales en el espacio y en el tiempo,
y que, por tanto, comprenden al mundo de la vida. El uso de leyes
tiene una importancia fundamental a la hora de optimizar el rigor científico de
una explicación. El marco matemático -no nos olvidemos- en el que ha crecido la
física, como caldo de cultivo de sus leyes, es el aparato dogmático más
aplicado por los científicos. Los modelos cuantitativos en
su contexto matemático están siendo introducidos hoy en una biología cada vez
más cuantitativa, pero, sobre todo, más legislada.
¿Qué es la medicina biofísica?
La
medicina biofísica entiende y deduce el funcionamiento de los organismos vivos
respecto a lo que llamamos salud, a través del estudio de las variables físicas
de los tejidos, órganos y sistemas, tales como temperatura, presión, volumen,
electromagnetismo, movilidad, acidez, humedad, fototropia, etc. Dichas
variables actúan en todos los eventos fisiológicos que ejecuta un organismo
vivo. La piedra angular de este tipo de medicina, es observar a la naturaleza,
pues los eventos físicos, químicos, biológicos, etc. que observamos en ésta,
también se reproducen en un organismo vivo como el cuerpo humano. Esta nueva
perspectiva ha marcado un hito en la historia de la medicina pues por fin
algunos médicos nos hemos dado cuenta que a la naturaleza no la podemos modificar
ni tampoco le podemos enseñar; al contrario tenemos muchísimo que aprender de
ella. Al tener este conocimiento, el médico biofísico no suprime los signos y
los síntomas que el organismo genera para defenderse de una enfermedad, al
contrario, analiza y deduce que para que se den estos signos y síntomas es
porque ha habido cambios en la presión, volumen, temperatura, PH y campo
magnético del órgano, tejido o sistema afectado. De esta misma manera,
cambiando los factores ya mencionados, el médico biofísico ayuda a su paciente
a recobrar la salud.
El Futuro de la Biofísica en Medicina
Se
define Biofísica como la ciencia que estudia la Biología aplicando
los principios y métodos de laFísica.
Este enfoque a la hora de estudiar organismos vivos resulta especialmente apropiado en situaciones como el estudio de los cambios energéticos que ocurren durante una reacción química catalizada por una enzima, que requieren más un enfoque físico que una hipótesis biológica.
Este enfoque a la hora de estudiar organismos vivos resulta especialmente apropiado en situaciones como el estudio de los cambios energéticos que ocurren durante una reacción química catalizada por una enzima, que requieren más un enfoque físico que una hipótesis biológica.
En
la actualidad, varias especialidades de la Medicina están encontrando numerosas
aplicaciones de los nuevos descubrimientos en el campo de la Biofísica.
Método Científico Introducción a la
Física
La ciencia
es un conjunto de conocimientos que obtenemos del mundo en que
vivimos, esto quiere decir que el simple conocimiento actual se entiende
como una actitud frente a la interpretación de
los fenómenos naturales que ocurren en el universo que nos
rodea.
El
hombre ha podido resolver muchos problemas gracias a la ciencia la cual se ha
desarrollado gradualmente a través de los siglos, fue evolucionando
de la historia de la humanidad con la participación de muchos
hombres y civilizaciones como: egipcia, Griega, Mesopotámica.
A todo esto decimos que el método científico es una serie ordenada de procedimientos que hace uso la investigación científica para observar la extensión de nuestros conocimientos.
A todo esto decimos que el método científico es una serie ordenada de procedimientos que hace uso la investigación científica para observar la extensión de nuestros conocimientos.
Cinco pasos del Método Científico:
1) Observación: Consiste
en la recopilación de hechos acerca de un problema
o fenómeno natural que despierta nuestra curiosidad, las
observaciones deben ser lo más claras y numerosas posibles porque han de servir
como base de partida para la solución.
2) Hipótesis: Es
la explicación ante el hecho observado. Consiste en que nos
proporcione una interpretación de los hechos que disponemos, debe ser
puesta a prueba por observaciones y experimentos posteriores. El objeto de una
buena hipótesis consiste solamente en darnos
una explicación para estimularnos a hacer más experimentos y
observaciones.
3) Experimentación: Consiste
en la verificación de la hipótesis, determina la validez
de las posibles explicaciones dadas, y decide que
una hipótesis se acepte o se deseche.
4) Teoría: Es
una hipótesis en la cual se han relacionado una gran cantidad de
hechos acerca del mismo fenómeno. Hipótesis en la cual se considera
mayor número de hechos, en la cual la explicación tiene mayor
probabilidad de ser comprobada positivamente.
5)
Ley: Es un conjunto de hechos derivados, observaciones y experimentos
debidamente reunidos, clasificados e interpretados que se consideran
demostrados. Nos permite predecir el desarrollo y evolución de
cualquier fenómeno natural.
Principales Rasgos que distinguen
al método científico
a)
Objetividad: Se intenta obtener un conocimiento que concuerde con la
realidad del objeto, que lo describa, o explique tal cual es y no como desearíamos que
fuese. Se deja a un lado lo objetivo, lo que se siente o presiente.
b)
Racionalidad: La ciencia que utiliza la razón como
arma esencial para llegar a sus resultados. Aleja a la ciencia de
la religión y de todos los sistemas donde aparecen elementos no
racionales o donde se apela a principios explicativos extras o sobrenaturales.
c)
Inventividad: Es inventivo porque se requiere poner en juego la
creatividad y la imaginación, para plantear problemas,
establecer hipótesis, resolverlas y comprobarlas. Significa que para
extender nuestros conocimientos se requiere descubrir nuevas verdades
el método nos da reglas y orientaciones pero no son infalibles.
d)
Sistematicidad: La ciencia es sistemática, organizada en
sus búsquedas y en sus resultados. Se preocupa por construir sistemas
de ideas organizadas coherentes e incluir todo conocimiento parcial en
conjuntos más amplios.
e)
Generalidad: La preocupación científica no es tanto a
ahondar y completar el conocimiento de un solo objeto individual sino
lograr que cada conocimiento parcial sirva como puente para alcanzar
una comprensión de mayor alcance.
f)
Falibilidad: La ciencia es uno de los pocos sistemas elaborados por
el hombre donde se reconoce explícitamente la propia posibilidad
de equivocación, de cometer errores.
g)
Verificabilidad: Es la confirmación o rechazo de
la hipótesis. Se verifican o se rechazan las hipótesis por medio
del método experimental.
h)
Perfectibilidad: Significa que
el método es susceptible de ser modificado, mejorado o
perfeccionado.
i)
Normatividad: Significa que el método es un procedimiento, es
una guía, y como tal nos proporciona principios, técnicas para
la investigación. La técnica es el conjunto de procedimientos
que sirve a una ciencia o arte.
3. ESTRUCTURA DE LA MATERIA. EL ELECTRÓN. EL PROTÓN. EL NEUTRÓN
Suponga que toma una muestra del
elemento cobre y se divide
en pedazos cada vez más pequeños. Antes de 1800, se pensaba que la materia era
continua, es decir que podía ser dividida en infinitas partes más pequeñas sin
cambiar la naturaleza del
elemento. Sin embargo, alrededor de 1803 ganó aceptación la teoría de un
científico inglés llamado Jhon Dalton (17766-1844). La
naturaleza de la materia y la forma en que los elementos se combinaban, sugería
la existencia de un límite a lo que un elemento podía subdividirse.
Ahora sabemos que al dividir una muestra de cobre
en trozos cada vez más pequeños, finalmente se encuentra una unidad básica que
no puede ser dividida sin cambiar la naturaleza del elemento. Esta unidad
básica se llama Átomo.
Un átomo es la
partícula más pequeña que puede existir de un elemento conservando las
propiedades de dicho elemento.
Para esta unidad se tienen dos objetivos, primero se
examinará la naturaleza de átomo en la forma que se encuentra en los elementos
y compuestos. Luego se verá más de cerca el átomo, con el objeto de comprender
su estructura interna; las
partes de que se compone.
Lo primero de que nos debemos percatar es que los
átomos son extremadamente pequeño, ya que l diámetro de un átomo es del orden
de 10-8 cm, se necesitarían 100 millones de átomos en una línea recta para
alcanzar una longitud de 1 cm.
Aproximadamente 400 a.C., el filósofo griego Demócrito sugirió que toda la
materia estaba formada por partículas minúsculas, discretas e indivisibles, a
las cuáles llamó átomos. Sus ideas fueron rechazadas durante 2000 años, pero a
finales del siglo dieciocho comenzaron a ser aceptadas.
En 1808, el maestro de escuela inglés, Jhon
Dalton, publicó las primeras ideas "modernas" acerca de la existencia
y naturaleza de los átomos. Resumió y amplió los vagos conceptos de
antiguos filósofos y
científicos. Esas ideas forman la base de la Teoría Atómica de Dalton, que es
de las más relevantes dentro del pensamiento científico.
Los postulados de Dalton se pueden enunciar:
1. Un elemento
está compuesto de partículas pequeñas e indivisibles llamadas átomos.
2. Todos los
átomos de un elemento dado tienen propiedades idénticas, las cuales difieren de
las de átomos de otros compuestos
3. Los átomos
de un elemento no pueden crearse, ni destruirse o transformarse en átomos de
otros elementos.
4. Los
compuestos se forman cuando átomos de elementos diferentes se combinan entre sí
en una proporción fija.
5. Los números
relativos y tipos de átomos son constantes en un compuesto dado.
En la época de Dalton se conocían la Ley de la
Conservación de la Materia y la Ley de las Proporciones Definidas, las cuales
fueron la base de su teoría atómica. Dalton consideró que los átomos eran
esferas sólidas e indivisibles, idea que en la actualidad se rechaza, pero
demostró puntos de vista importantes acerca de la naturaleza de la materia y
sus interacciones.
En ese tiempo algunos de
sus postulados no pudieron verificarse (o refutarse) experimentalmente, ya que
se basaron en limitadas observaciones experimentales de su época. Aún con sus
limitaciones, los postulados de Dalton constituyen un marco de referencia que
posteriormente los científicos pudieron modificar o ampliar.
Partículas Fundamentales:
Las partículas fundamentales de un átomo son los
bloques constituyentes básicos de cualquier átomo. El átomo, y por tanto toda
la materia está formado principalmente por tres partículas fundamentales:
electrones, neutrones y protones. El conocimiento de la
naturaleza y la forma en que funcionan es fundamental para comprender las
interacciones químicas.
La masa y las cargas de las tres partículas
fundamentales se muestran en la siguiente tabla.
Partícula
|
Masa (uma)
|
Carga
|
Electrón (e-)
|
0.00054858
|
1-
|
Protón (p+)
|
1.0073
|
1+
|
Neutrón (nº)
|
1.0087
|
Ninguna
|
La masa del electrón es muy pequeña en comparación
con la masa del protón o del neutrón. La carga del protón es de magnitud igual
pero de signo opuesto a la carga del electrón. Procederemos a estudiar estas
partículas con mayor detalle.
El electrón
El electrón, comúnmente representado como e− es una partícula subatómica. En un átomo los electrones rodean el núcleo, compuesto de protones y neutrones. Los electrones tienen la carga eléctrica más pequeña, y su movimiento genera corriente eléctrica. Dado que los electrones de las capas más externas de un átomo definen las atracciones con otros átomos, estas partículas juegan un papel primordial en la química.
El electrón, comúnmente representado como e− es una partícula subatómica. En un átomo los electrones rodean el núcleo, compuesto de protones y neutrones. Los electrones tienen la carga eléctrica más pequeña, y su movimiento genera corriente eléctrica. Dado que los electrones de las capas más externas de un átomo definen las atracciones con otros átomos, estas partículas juegan un papel primordial en la química.
Historia y descubrimiento del electrón
La existencia del electrón fue postulada por G.
Johnstone Stoney, como una unidad de carga en el campo de la electroquímica. El electrón fue descubierto
por Thomson en 1897 en el Laboratorio Cavendish de
la Universidad de
Cambridge, mientras estudiaba el comportamiento de los rayos
catódicos. Influenciado por el trabajo de Maxwell y
el descubrimiento de los rayos X, dedujo que en el tubo de rayos catódicos
existían unas partículas con carga negativa que denominó corpúsculos.
Aunque Stoney había propuesto la existencia del
electrón fue Thomson quién descubrió su carácter de partícula fundamental. Para
confirmar la existencia del electrón era necesario medir sus propiedades, en
particular su carga eléctrica. Este objetivo fue
alcanzado por Millikan en el célebre experimento de la gota de aceite realizado en
1909.
George Paget Thomson, hijo de J.J. Thomson, demostró
la naturaleza ondulatoria del electrón probando la dualidad onda-corpúsculo
postulada por la mecánica cuántica. Este descubrimiento
le valió el Premio Nobel de Física de
1937.
El spin del electrón se observó por vez primera en
el experimento de Stern-Gerlach. Su carga eléctrica puede medirse directamente
con un electrómetro, y la corriente generada por su movimiento con un
galvanómetro.
El protón
Partícula nuclear con carga positiva igual en magnitud a la carga negativa del electrón; junto con el neutrón, está presente en todos los núcleos atómicos. Al protón y al neutrón se les denomina también nucleones. El núcleo del átomo de hidrógeno está formado por un único protón. La masa de un protón es de 1,6726 × 10-27 kg, aproximadamente 1.836 veces la del electrón. Por tanto, la masa de un átomo está concentrada casi exclusivamente en su núcleo. El protón tiene un momento angular intrínseco, o espín, y por tanto un momento magnético. Por otra parte, el protón cumple el principio de exclusión.
Partícula nuclear con carga positiva igual en magnitud a la carga negativa del electrón; junto con el neutrón, está presente en todos los núcleos atómicos. Al protón y al neutrón se les denomina también nucleones. El núcleo del átomo de hidrógeno está formado por un único protón. La masa de un protón es de 1,6726 × 10-27 kg, aproximadamente 1.836 veces la del electrón. Por tanto, la masa de un átomo está concentrada casi exclusivamente en su núcleo. El protón tiene un momento angular intrínseco, o espín, y por tanto un momento magnético. Por otra parte, el protón cumple el principio de exclusión.
El número atómico de un elemento indica el número
de protones de su núcleo, y determina de
qué elemento se trata. En física nuclear, el protón se emplea como proyectil en
grandes aceleradores para
bombardear núcleos con el fin de producir partículas fundamentales. Como ion
del hidrógeno, el protón desempeña un papel importante en la química.
El antiprotón, la antipartícula del protón,
se conoce también como protón negativo. Se diferencia del protón en que
su carga es negativa
y en que no forma parte de los núcleos atómicos. El antiprotón es
estable en el vacío y no se desintegra espontáneamente. Sin embargo, cuando un
antiprotón colisiona con un protón, ambas partículas se transforman en mesones, cuya vida media
es extremadamente breve. Si bien la existencia de esta partícula elemental se
postuló por primera vez en la década de 1930, el antiprotón no se identificó
hasta 1955, en el Laboratorio de Radiación de la
Universidad de California.
El neutrón
El Neutrón es una partícula eléctricamente neutra, de masa 1.838,4 veces mayor que la del electrón y 1,00014 veces la del protón; juntamente con los protones, los neutrones son los constitutivos fundamentales del núcleo atómico y se les considera como dos formas de una misma partícula: el nucleón.
El Neutrón es una partícula eléctricamente neutra, de masa 1.838,4 veces mayor que la del electrón y 1,00014 veces la del protón; juntamente con los protones, los neutrones son los constitutivos fundamentales del núcleo atómico y se les considera como dos formas de una misma partícula: el nucleón.
La existencia de los neutrones fue descubierta en
1932 por Chadwick; estudiando la radiación emitida por el berilio bombardeado
con partículas, demostró que estaba formada por partículas neutras de
gran poder de
penetración, las cuales tenían una masa algo superior a la del protón.
El número de neutrones en un núcleo estable es
constante, pero un neutrón libre, en decir, fuera del núcleo, se desintegra con
una vida media de unos 1000 segundos, dando lugar a un protón, un electrón y un
neutrino.
En un núcleo estable, por el contrario, el electrón
emitido no tiene la energía suficiente para vencer la atracción coulombiana del
núcleo y los neutrones no se desintegran. La fuente de neutrones de mayor
intensidad disponible hoy día es el reactor nuclear. El proceso fundamental
que conduce a la producción de energía nuclear es la fisión
de un núcleo de uranio originado por un neutrón: en la fisión el núcleo se
escinde en dos partes y alrededor de tres neutrones por término medio
(neutrones rápidos); los fragmentos resultantes de la escisión emiten, además
otros neutrones.
4.
POSITRON O ANTIELECTRON
El positrón o antielectrón, es la
antipartícula de un electrón, el positrón tiene una carga positiva, si un positrón y
un electrón logran una fusión (combinación). La reacción e+ + e- → γ + γ se conoce como aniquilación positrón-electrón.se aniquilan y así
se convierten en partículas de, rayo gamma, es por definición energía. Cuando en
el universo temprano los fotones eran
convertidos continuamente en un par de positrones y electrones, y luego estos en
fotones.
El positrón al ser una antipartícula
correspondiente a un electrón, ya que esto poseen la misma carga eléctrica y la
misma masa, (aunque de diferente signo, ya que es positiva) ya explicamos que
con el signo contrario (positivo). Este no forma parte de la materia ordinaria, forma parte de la
antimateria, a pesar de que se producen en determinados procesos radioactivos,
es parte de las transformaciones nucleares.
Esta partícula fue
predicha por Paul Dirac en el año de 1928, para luego ser descubierta en el año
1932 por el físico norteamericano Anderson al fotografiar las huellas de los
rayos cósmicos en una cámara de niebla.
En la actualidad los
positrones son rutinariamente producidos en la Tomografía por emisión de
positrones usados en las instalaciones hospitalarias.
5.
NIVELES DE ORGANIZACIÓN DE LA MATERIA
La materia viva e inerte se puede encontrar en diversos estados de agrupación diferentes. Esta agrupación u organización puede definirse en una escala de organización que sigue de la siguiente manera de menor a mayor organización.
Subatómico: este nivel es el más simple de todo y está
formado por electrones, protones y neutrones, que son las distintas partículas
que configuran el átomo.
Átomo:
es el siguiente nivel de organización.
Es un átomo de oxígeno, de hierro, de cualquier elemento químico.
Moléculas:
las moléculas consisten en la unión de
diversos átomos diferentes para forma, por ejemplo, oxígeno en estado gaseoso
(O2), dióxido de carbono, o simplemente carbohidratos, proteínas, lípidos...
Celular:
las moléculas se agrupan en unidades
celulares con vida propia y capacidad de autor replicación.
Tisular: las células se organizan en tejidos:
epitelial, adiposo, nervioso, muscular...
Orgánulo: los tejidos están estructuras en órganos:
corazón, bazo, pulmones, cerebro, riñones...
Sistémico
o de aparatos: los órganos se estructuran en
aparatos digestivos, respiratorios, circulatorios, nerviosos...
Organismo:
nivel de organización superior en el cual las células, tejidos, órganos y
aparatos de funcionamiento forman una organización superior como seres vivos:
animales, plantas, insectos,...
Población:
los organismos de la misma especie se
agrupan en determinado número para formar un núcleo poblacional: una manada de
leones, o lobos, un bosque de arces, pinos...
Comunidad:
es el conjunto de seres vivos de un
lugar, por ejemplo, un conjunto de poblaciones de seres vivos diferentes. Está
formada por distintas especies.
Ecosistema:
es la interacción de la comunidad
biológica con el medio físico, con una distribución espacial amplia.
Paisaje:
es un nivel de organización superior
que comprende varios ecosistemas diferentes dentro de una determinada unidad de
superficie. Por ejemplo, el conjunto de vid, olivar y almendros características
de las provincias del sureste español.
Región: es un nivel superior al de paisaje y supone
una superficie geográfica que agrupa varios paisajes.
Bioma:
Son ecosistemas de gran tamaño
asociados a unas determinadas características ambientales: macro climáticas
como la humedad, temperatura, radiación y se basan en la dominancia de una
especie aunque no son homogéneos. Un ejemplo es la taiga que se define por las
coníferas que es un elemento identificador muy claro pero no homogéneo, también
se define por la latitud y la temperatura.
Biosfera:
es todo el conjunto de seres vivos y componentes inertes
que comprenden el planeta tierra, o de igual modo es la capa de la atmósfera en
la que existe vida y que se sustenta sobre la litosfera.
6.
GENERARILADES DE LOS COMPUESTOS QUIMICOS.
TABLA PERIODICA
Un compuesto es la sustancia que
resulta de la unión de dos o más elementos químicos, combinados en cantidades
exactas y fijas a través de enlaces químicos.
Todas
las moléculas de un compuesto tienen la misma combinación de elementos. Por ejemplo el agua (H2 O),
todas las moléculas de agua tienen los mismos 3 átomos (2 átomos de
hidrógeno y un átomo de oxígeno)
CLASIFICACIÓN:
u INORGANICOS:
Se denomina compuesto químico inorgánico a todos aquellos compuestos que están formados por distintos elementos, pero en los que su componente principal no siempre es el carbono, siendo el agua el más abundante. En los compuestos inorgánicos se podría decir que participan casi la totalidad de elementos conocidos.
Se denomina compuesto químico inorgánico a todos aquellos compuestos que están formados por distintos elementos, pero en los que su componente principal no siempre es el carbono, siendo el agua el más abundante. En los compuestos inorgánicos se podría decir que participan casi la totalidad de elementos conocidos.
u ORGANICOS:
Es una sustancia química que contiene carbono, formando enlaces carbono-carbono y carbono-hidrógeno.
Es una sustancia química que contiene carbono, formando enlaces carbono-carbono y carbono-hidrógeno.
En muchos
casos
contienen oxígeno, nitrógeno, azufre, fósforo, boro, halógenos y
otros elementos menos frecuentes en su estado natural. Estos
compuestos se denominan moléculas orgánicas.
TABLA PERIODICA
En 1895 Moseley y Werner manifestaron que los
electrones debían estar clasificados en orden creciente de su número atómica y
no de su peso atómico. Ellos pudieron separar cada grupo en subgrupos A y B,
ahora conocidos como IA y IB. Que más tarde lo perfecciono Julius Thomsen.
La ley periódica moderna actualmente dice que el
comportamiento químico de los elementos es función periódica de su
configuración electrónica.
En la tabla periódica se encuentran clasificados los
elementos, en cada uno consta el símbolo químico y dos valores que son el
número atómico y la masa atómica. Algunas tablas incluyen la distribución de
los electrones, también tiene dos disposiciones llamados: periodos y grupos.
Ø
Periodos
Se dirigen horizontalmente en forma de renglones, de
arriba hacia abajo, son siete, marcados con números arábigos: 1, 2, 3, 4, 5, 6,
7, que representan el numero cuántico principal (n) y que correspondan a las
capas K, L, M, N, O, P, Q, llamadas periodos. Por lo tanto, el periodo indica
el número de niveles o capas que llevan un elemento.
Período
|
No. de niveles
|
No. de capas
|
No. Máx. de elec. 2n2
|
No. De elem. Por per.
|
1
|
1
|
K
|
2
|
2
|
2
|
2
|
KL
|
8
|
8
|
3
|
3
|
KLM
|
18
|
8
|
4
|
4
|
KLMN
|
32
|
18
|
5
|
5
|
KLMNO
|
50
|
18
|
6
|
6
|
KLMNOP
|
72
|
32
|
7
|
7
|
KLMNOPQ
|
98
|
29*
|
Ø
Grupos
Estos se dirigen de izquierda a derecha en ocho
columnas verticales marcadas con números romanos. I, II, III, IV, V, VI, VII,
VIII indican el número de electrones que lleva un elemento en su último nivel.
Por ejemplo, los elementos que se encuentran en el
grupo I tienen un solo electrón en su último nivel ns1 como es el
caso de los elementos H, Li, Na, K, Rb, Cs, Fr. Por lo tanto, el grupo indica
el número de electrones que lleva un elemento en su último nivel.
Subgrupos o
familias
En su mismo grupo se clasificaban los elementos que
tenían propiedades comunes y claras diferencias. Razón por la cual cada grupo
se dividió en dos subgrupos o familias denominadas con las letras A y B. De ahí
que se hable del grupo IA y IB; del grupo IIA y IIB.
IA= Metales alcalinos (excepto el hidrógeno)
IIA= Metales alcalino térreos
IIIA= Grupo del boro
IVA=Grupo del carbono
VA= Grupo del nitrógeno
VIA= Grupo del oxigeno
VIIA= Halógenos
VIIIA= Gases nobles o inertes
Propiedades de
los elementos de la tabla periódica
ü
Propiedades no
periódicas.
·
Carga nuclear.
·
Masa atómica.
·
Calor
especifico.
ü
Propiedades
periódicas.
Estas propiedades se repiten ya sea cuando se separan
de un grupo a otro o de un periodo a otro con variaciones en los valores; entre
las principales propiedades periódicas se estudia:
·
Electronegatividad:
Es la capacidad
que tiene un átomo para atraer electrones.
El elemento más
electronegativo es el flúor cuyo valor es el 4 lo que significa que posee la
mayor fuerza para atraer electrones de otro átomo.
·
Energía de
ionización o potencial de ionización:
Todo átomo es
eléctricamente neutro y para que se transforme en ion requiere ganar o perder
electrones para cual necesita recibir energía externa para que el átomo se
excite; esto se llama energía de ionización.
·
Afinidad
electrónica:
Se define como
cambio de energía que ocurre cuando se agrega un electrón a un átomo gaseoso.
La ganancia de
electrones implica desprendimiento de energía:
Átomo (neutro)
– 1 Electrón + energía = ión positivo
Se dice que el
átomo tiene afinidad electrónica negativa y se calcula Kcal/ mol.
·
Radio atómico:
Sabemos que el átomo no tiene forma, es una
nube por lo que es imposible medir el radio de un solo átomo. Ante esta
dificultad se toma la distancia que existe entre núcleos de dos átomos
idénticos que están frente a frente.
·
Numero de
oxidación:
El número de
oxidación o valencia de un elemento que está formado por una molécula, es
positiva cuando ha perdido electrones
(oxidación) y es negativo cuando ha ganado electrones (reducción).
7.
ESTADOS DE LA MATERIA

En la naturaleza, la materia se nos presenta en tres estados físicos
diferentes: sólido, líquido y gaseoso. Aunque algunas sustancias, como el agua,
pueden existir en los tres estados, lo normal es que, en su estado natural,
cada sustancia aparezca en uno solo de ellos.
Propiedades de los solidos
Los sólidos se caracterizan por tener una gran fuerza de cohesión es
mayor que la de expansión entre sus moléculas, por lo que los solidó tienen una
forma, peso y volumen fijo. Los sólidos no se pueden comprimir ya que sus
moléculas se encuentran muy juntas.
La elasticidad es la tendencia a regresar a su forma original después de
haber sido sometido una fuerza extraña.
Esto lo podemos comprobar en un resorte.
La dureza es la propiedad de un sólido a no poder ser rayado por objetos
más blandos que el, un ejemplo claro es el diamante que no poder ser rayado por
el yeso.
La ductilidad, o facilidad que ofrece un sólido a extenderse formando
hilos. Por ejemplo, el cobre del que están hechos los hilos en el interior de
los cables de la luz.
La maleabilidad, o capacidad que presenta un sólido para extenderse en
forma de láminas. Por ejemplo, el oro y el aluminio son metales muy maleables.
La fragilidad o tendencia de los sólidos a romperse en pequeños
pedacitos.
La flexibilidad, o facilidad de un sólido a doblarse sin romperse. Por
ejemplo, podemos doblar una varita de mimbre o un folio de papel sin que se
rompan.
La resistencia, o capacidad de un sólido para soportar pesos sin romperse.
Por ejemplo, las casas se hacen con vigas de hierro o de hormigón, que soportan
el peso de muros y techos.
Propiedades de los líquidos
Los líquidos no tienen forma propia, sino que adoptan la forma del
recipiente que los contiene.
Las partículas que constituyen los líquidos están más alejadas entre sí
que en los sólidos, pero esta distancia no se puede hacer menor; por ello el
volumen de un líquido no cambia, es decir, los líquidos tienen volumen
constante.
Otras propiedades de los líquidos son la viscosidad y la volatilidad.
Decimos que un líquido es viscoso cuando
fluye muy lentamente, como la miel o el aceite, que son más viscosos que el
agua.
Decimos que un líquido es volátil cuando se evapora con facilidad. El
olor a gasolina en una gasolinera nos indica que se trata de un líquido
volátil.
Propiedades de los gases
Los gases no tienen una forma definida si no que al igual que al estado
líquido estos toman la forma del envase que los contiene. En el estado gaseoso
el espacio intermolecular es más grande que en el estado líquido y es por eso
que no tienen forma definida y adoptan todo el volumen del recipiente o envase
que los contiene.
Si con un dedo tapamos la boca de una jeringuilla y apretamos su émbolo,
éste avanzará pues el aire que hay en su interior se comprime, mientras que si
tiene agua, nos resultará imposible mover el émbolo, ya que los líquidos no se
comprimen.
Los gases son compresibles, esto es debido al espacio intermolecular que
poseen vale destacar que los sólidos y los líquidos no pueden comprimirse. Al
comprimir o enfriar un gas este puede pasar al estado líquido así como el gas
licuado que contiene las bombonas de butano.
8.
FENOMENOS
BIOFÍSICOS MOLECULARES
Los fenómenos
biofísicos moleculares son procesos que se realizan en los seres vivos, los
cuales se basan en leyes físicas y físico-químicas dando lugar a la formación
de dichos fenómenos. Los fundamentos moleculares de la Biofísica se rigen en
las biomoléculas, o macromoléculas, y su funcionamiento en todo aspecto.
Un fenómeno es un cambio en la
Naturaleza que no modifica la composición de la materia.
Por ejemplo:
- Mover un objeto de un sitio a otro.
- Doblar un papel.
- La formación de un huracán
- Dilatación del mercurio en un
termómetro
- Congelación del agua (en este caso,
no cambia la identidad de la materia porque el agua líquida ha pasado a agua
sólida)
9. TENSIÓN
SUPERFICIAL. PRESION HIDROSTATICA. ADHESIÓN Y COHESION. DIFUSION. OSMOSIS.
ABSORCION
Las moléculas de un líquido se atraen entre sí, esto se da por la fueras
cohesivas de un líquido de ahí que el
líquido esté "cohesionado".
Cuando hay una superficie, las moléculas que están justo debajo de la
superficie sienten fuerzas hacia los lados, horizontalmente, y hacia abajo,
pero no hacia arriba, porque no hay moléculas encima de la superficie. El
resultado es que las moléculas que se encuentran en la superficie son atraídas
hacia el interior de éste. Para algunos efectos, esta película de moléculas
superficiales se comporta en forma similar a una membrana elástica tirante (la
goma de un globo, por ejemplo). De este modo, es la tensión superficial la que
cierra una gota y es capaz de sostenerla contra la gravedad mientras cuelga
desde un gotario. Ella explica también la formación de burbujas.
La tensión superficial, se mide normalmente en dinas/cm., la fuerza que
se requiere (en dinas) para romper una película de 1 cm. de longitud. Se puede
establecer de forma equivalente la energía superficial en ergios por centímetro
cuadrado. El agua a 20°C tiene una tensión superficial de 72.8 dinas/cm
comparada con 22.3 para el alcohol etílico y 465 para el mercurio.
Presión hidrostática
La presión hidrostática es la fuerza por unidad de área que ejerce un
líquido en reposo sobre las paredes del recipiente que lo contiene y sobre
cualquier cuerpo que se encuentre sumergido, como esta presión se debe al peso
del líquido, esta presión depende de la densidad (p), la gravedad (g) y la
profundidad (h) del el lugar donde medimos la presión.
(P)P=p*g*h
Un fluido pesa y ejerce presión sobre las
paredes, sobre el fondo del recipiente que lo contiene y sobre la superficie de
cualquier objeto sumergido en él recipiente. Esta presión hidrostática provoca,
en fluidos en reposo, una fuerza perpendicular a las paredes del recipiente o a
la superficie del objeto sumergido sin importar la orientación que adopten las
caras. Si el líquido tuviera movimiento, las fuerzas resultantes de las
presiones ya no serían necesariamente perpendiculares a las superficies a lo
que se llama presión hidrodinámica.
Adhesión
La adhesión o adherencia es la propiedad de la materia por la cual se
juntan dos superficies de sustancias iguales o diferentes cuando entran en
contacto, manteniéndose unidas por fuerzas intermoleculares.
* Adhesión mecánica. En este caso, los materiales adhesivos rellenan los
huecos o porosidades de las superficies, uniéndose por enclavamiento. Por
ejemplo, el velcro.
* Adhesión química: La unión de dos materiales producen un compuesto
químico.
* Adhesión dispersiva: Los materiales mantienen su adhesión por las
fuerzas de van der Walls: la atracción entre dos moléculas, cada una de las
cuales tiene regiones de carga positiva y negativa. Este efecto puede ser
permanente o temporal, debido al movimiento constante de los electrones en una
región.
* Adhesión electrostática: la unión de dos materiales produce una
diferencia de potencial, debido a que son materiales conductores de electrones.
Esto crea una fuerza electrostática atractiva entre materiales.
* Adhesión difusiva: Dos materiales se adhieren porque las moléculas de
ambos son móviles y solubles entre sí.
Cohesión
Es la atracción entre moléculas que mantiene unidas las partículas de
una sustancia. La cohesión es diferente de la adhesión; la cohesión es la
fuerza de atracción entre partículas
adyacentes dentro de un mismo cuerpo, mientras que la adhesión es la
interacción entre las superficies de distintos cuerpos.
En el agua la fuerza de cohesión es elevada por causa de los puentes de
hidrogeno que mantienen las moléculas de agua fuertemente unidas, formando una
estructura compacta que la convierte en un líquido casi incompresible.
Al no poder comprimirse puede
funcionar en algunos animales como un esqueleto hidrostático, como ocurre en
algunos gusanos perforadores capaces de agujerear la roca mediante la presión
generada por sus líquidos internos.
También en los gases, la fuerza de cohesión puede observarse en su
licuefacción, que tiene lugar al comprimir una serie de moléculas y producirse
fuerza de atracción suficiente mente altas para proporcionar una estructura
liquida.
Difusión
Se define la Difusión como el
movimiento de las moléculas de una región de alta concentración a otra
de menor concentración, producido por la energía cinética de las moléculas
(figura 1.1). La velocidad de Difusión es una función del tamaño de la molécula
y de la temperatura.
Difusión simple
Es el movimiento de las moléculas en el fluido, desde las regiones de
alta concentración hasta las de menor concentración, como es el caso del agua,
gases disueltos (oxigeno, dióxido de carbono) y moléculas liposolubles (alcohol
etílico y la vitamina A) que cruzan la membrana con facilidad.
Por difusión simple se intercambian sustancias disueltas de muy bajo
peso molecular, cuanto menor tamaño molecular y mayor carácter hidrófobo, mejor
difunde una sustancia a través de la membrana. Es la difusión de agua, gases
disueltos o moléculas liposolubles por la capa doble de fosfolípidos de la
membrana citoplasmática.
Difusión facilitada
Por difusión mediada o facilitada atraviesan la membrana sustancias que
requieren la mediación de proteínas de membrana que las reconocen
específicamente y permiten su paso sin que lleguen a tomar contacto directo con
los lípidos hidrofóbicos. Se puede transportar un soluto específico desde el
interior de la célula al exterior o viceversa, pero el movimiento neto es
siempre desde una región de mayor concentración de soluto a una de menor
concentración
Las proteínas implicadas en la difusión mediada son largas cadenas
polipeptídicas y pueden ser de dos clases, proteínas transportadoras y
proteínas de canal.
La difusión mediada por permeasas implica la unión específica de la
sustancia a la proteína en una cara de la membrana.
La difusión mediada por proteínas de canal éstas no se unen a la sustancia.
Permiten principalmente el paso de iones a mucha mayor velocidad que las
permeasas.
Osmosis
La ósmosis es un fenómeno físico relacionado con el comportamiento de un
fluido como solvente de una solución ante una membrana semipermeable para el
solvente pero no para los solutos. Tal comportamiento entraña una difusión
simple a través de la membrana, sin "gasto de energía". La ósmosis
del agua es un fenómeno biológico importante para la fisiología celular de los
seres vivos.
Cuando la ósmosis es el mecanismo por el cual las sustancias infectadas
se difunden por las células, se puede considerar una enfermedad, aunque el
virus en si es la enfermedad, el mecanismo completo va a ser considerado.
Absorción
Proceso de transporte activo o pasivo de una sustancia química hacia el
interior del organismo o cuerpo, generalmente a través de los pulmones, el tracto
gastrointestinal o la piel.
Por medio de este proceso nuestro cuerpo puedo obtener las sustancias
necesarias para poder sobrevivir, ya que al adsorber los alimentos tomamos los
carbohidratos, lípidos, proteínas; que son parte fundamental de nuestro organismo
10.
ACCION CAPILAR Y CAPILARIDAD
Atracción capilar, o
capilaridad, es la capacidad de un líquido a fluir en espacios estrechos en
oposición a fuerzas externas como la gravedad. El efecto puede ser visto en la
elaboración de líquidos entre los pelos de un pincel, en un tubo delgado, en
materiales porosos tales como papel, en algunos materiales no porosos tales
como fibra de carbono licuado, o en una célula. Ocurre debido a fuerzas
intermoleculares entre las superficies circundantes líquidas y sólidas. Si el
diámetro del tubo es suficientemente pequeño, entonces la combinación de la
tensión superficial y las fuerzas adhesivas entre el líquido y el acto de
levantar el recipiente de líquido.
La acción capilar ocurre porque el agua
es pegajosa -- las moléculas del agua se pegan unas a otras y a otras
substancias como el vidrio, la ropa, tejidos orgánico y la tierra. Ponga una
toalla de papel dentro de un vaso de agua y el agua se le "pegará" a
la toalla de papel. Aún más, empezará el agua a moverse hacia arriba de la
toalla hasta que el jalón de la gravedad sea mucho para ella y no pueda
continuar.
11.
FENOMENO FISICO Y QUIMICO
Fenómeno físico
La materia puede experimentar dos tipos de cambios o fenómenos, estos
son uno químico y otro físico.
El fenómeno físico se refiere cuando la materia sufre cambios pero solo
en su estructura y no en su naturaleza. Este tipo de fenómenos son reversibles
ósea que pueden regresar a la normalidad o al punto de origen.
Como ejemplo podemos ver que al colocar sal en un vaso de agua ninguno
de los dos va a perder sus características y podrán volver a la normalidad. Al
calentar el agua la sal se va a cristalizar al fondo del recipiente.
Fenómeno químico
Los fenómenos químicos se diferencian de los físicos ya que en estos la
materia si va perder sus características
y su naturaleza va a cambiar.
Ya que en estos fenómenos los compuestos se van a combinar con otros y
van a formar nuevos compuestos con características distintas. Además estos
procesos no son reversibles.
Un ejemplo de esto es la combustión de la madera, en esta reacción va
actuar la madera y el oxígeno para producir un nuevo compuesto que es el
dióxido de carbono.
12.
TERMOMETRIA.CALORIMETRIA. ENERGIA, TRABAJO Y
CALOR
La termodinámica es una
ciencia experimental cuyo objetivo es estudiar a la energía Térmica (calor) y
sus diferentes transformaciones en otras formas de energías.
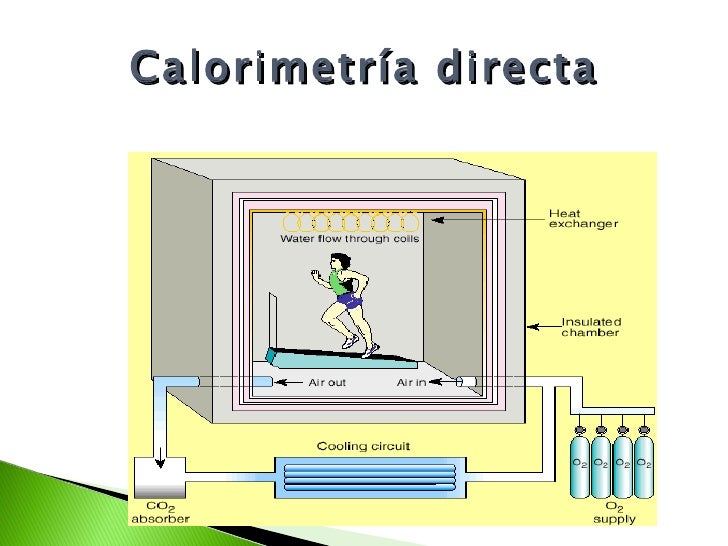
Calorimetría
La calorimetría es la ciencia de medir
el calor de las reacciones químicas o de los cambios físicos. El instrumento utilizado en calorimetría se denomina
calorímetro. La palabra calorimetría deriva del latino "calor". El
científico escocés Joseph Black fue el primero en reconocer la distinción entre
calor y temperatura, por esto se lo considera el fundador de calorimetría.
La calorimetría indirecta calcula el
calor que producen los organismos vivos mediante su producción de dióxido de
carbono y de los residuos de nitrógeno (frecuentemente amoníaco en organismos
acuáticos o, también, urea en los terrestres). Además la producción de calor
puede ser calculada por el consumo de oxígeno de los animales.
Energía
La energía es una propiedad asociada a
los objetos y sustancias y se manifiesta en las transformaciones que ocurren en
la naturaleza.
La energía se manifiesta en los cambios
físicos, por ejemplo, al elevar un objeto, transportarlo, deformarlo o
calentarlo.
La energía está presente también en los
cambios químicos, como al quemar un trozo de madera o en la descomposición de
agua mediante la corriente eléctrica
La energía es la capacidad de los cuerpos para realizar
un trabajo y producir cambios en ellos
mismos o en otros cuerpos. Es decir, la energía es la capacidad de hacer
funcionar las cosas.
La unidad de medida que utilizamos para
cuantificar la energía es el Joule (J).
Trabajo
Refiere a una actividad propia del ser
humano. También otros seres actúan dirigiendo sus energías coordinadamente y
con una finalidad determinada. Sin embargo, el trabajo propiamente dicho,
entendido como proceso entre la naturaleza y el hombre, es exclusivamente
humano. En este proceso el hombre se enfrenta como un poder natural, en
palabras de Karl Marx, con la materia de la naturaleza
Calor
El calor es una cantidad de energía y
es una expresión del movimiento de las moléculas que componen un cuerpo.
Cuando el calor entra en un cuerpo se
produce calentamiento y cuando sale, enfriamiento. Incluso los objetos más
fríos poseen algo de calor porque sus átomos se están moviendo.
13.
TEMPERATURA Y ESCALAS DE TERMOMETRÍA
Temperatura (T)
Es una propiedad termométrica
de 1 cuerpo y representa a la medida de la agitación molecular o atómica que realiza un determinado
cuerpo. La temperatura es una magnitud que mide también la energía
interna de los cuerpos.
Escalas de termometría
Para graduar cualquier termómetro se necesitan dos
puntos fijos entre los cuales definir la unidad de temperatura. Comúnmente se
utilizan el punto de fusión del hielo y el punto de ebullición del agua.
Actualmente se usan tres escalas de temperaturas
que son: la Centígrada o Celsius, la de Kelvin o Absoluta y la de Fahrenheit.
Los termómetros se fabrican de forma idéntica,
aunque tengan diferentes escalas.
La escala Celsius es usada en Europa continental y
los países latinoamericanos en la vida diaria.
Ésta da el valor 0ºC a la temperatura de fusión del
hielo y 100ºC a la de evaporación del agua (figura 3).
La escala Kelvin es usada en todo el mundo para
medidas científicas, ésta tiene en cuenta que existe una temperatura mínima
posible, que corresponde al estado de reposo de las moléculas que componen un
cuerpo y le asigna el valor 0 K (cero absoluto) quedando así determinado el
valor 273K para la temperatura de fusión del hielo y 373K para la de
evaporación del agua. De esta manera el 0 K coincide con –273 ºC.
Por último la escala Fahrenheit, que se usa en la
vida diaria en los EE.UU. y en el Reino Unido, asigna el valor 32ºF y 212ºF
para los puntos de fusión del hielo y evaporación del agua.
Para graduar un termómetro, se pone el bulbo dentro
de una mezcla de hielo y agua y se marca en el tubo la altura a que llega el
mercurio. Después se coloca en vapor que se desprende del agua hirviendo y se señala el nuevo nivel. Estas dos marcas
determinan los puntos fijos de las escalas, que se vaya a usar después
14.
PROPAGACION DE CALOR. MECANISMOS
El calor es una de las
múltiples formas en que se manifiesta la energía, y la transferencia de calor es el
proceso mediante el cual se intercambia energía en forma de calor entre
distintos cuerpos o entre diferentes partes de un cuerpo que estén a
temperaturas desiguales. La transferencia de calor ocurre mediante convección, radiación y conducción. Estas tres formas pueden producirse a la vez, aunque por lo regular
predomina una de ellas.
Conducción: La conducción es la manera de
transferir calor desde una masa de temperatura más elevada a otra de
temperatura inferior por contacto directo. El coeficiente de conducción de un
material mide la capacidad del mismo para conducir el calor a través de la masa
del mismo. Los materiales aislantes tienen un coeficiente de conducción pequeño
por lo que su capacidad para conducir el calor es reducida, de ahí su utilidad.
Convección: La transmisión
de calor por convección es
un intercambio de calor entre el aire y una masa material que se encuentran a
diferentes temperaturas. El transporte del calor se produce por movimientos naturales
debidos a la diferencia de temperaturas, el aire caliente tiende a subir y el
aire frío baja, o bien mediante mecanismos de convección forzada.
Radiación: Es un mecanismo
de transmisión de calor en el que el intercambio se produce mediante la absorción
y emisión de energía por ondas electromagnéticas, por lo que no existe la
necesidad de que exista un medio material para el transporte de la energía. El
sol aporta energía exclusivamente por radiación.
15. LEYES DE LA
TERMODINÁMICA. LA ENTALPIA. ENTROPÍA

La termodinámica puede definirse como el tema de la Física que estudia los procesos en los que se transfiere energía como calor y como trabajo.
Primera Ley de la
Termodinámica
Esta ley se expresa como:
Eint = Q - W
Cambio en la energía interna en el sistema = Calor agregado (Q) -
Trabajo efectuado por el sistema (W)
Notar que el signo menos en el lado derecho de la ecuación se debe
justamente a que W se define como el trabajo efectuado por el sistema.
Para entender esta ley, es útil imaginar un gas encerrado en un
cilindro, una de cuyas tapas es un émbolo móvil y que mediante un mechero
podemos agregarle calor. El cambio en la energía interna del gas estará dado
por la diferencia entre el calor agregado y el trabajo que el gas hace al
levantar el émbolo contra la presión atmosférica.
Segunda Ley de la
Termodinámica
La primera ley nos dice que la energía se conserva. Sin embargo, podemos
imaginar muchos procesos en que se conserve la energía, pero que realmente no
ocurren en la naturaleza. Si se acerca un objeto caliente a uno frío, el calor
pasa del caliente al frío y nunca al revés. Si pensamos que puede ser al revés,
se seguiría conservando la energía y se cumpliría la primera ley.
En la naturaleza hay procesos que suceden, pero cuyos procesos inversos
no. Para explicar esta falta de reversibilidad se formuló la segunda ley de la
termodinámica, que tiene dos enunciados equivalentes:
Enunciado de Kelvin - Planck : Es imposible construir una máquina
térmica que, operando en un ciclo, no produzca otro efecto que la absorción de
energía desde un depósito y la realización de una cantidad igual de trabajo.
Enunciado de Clausius: Es imposible construir una máquina cíclica cuyo
único efecto sea la transferencia continua de energía de un objeto a otro de
mayor temperatura sin la entrada de energía por trabajo.
Tercera ley
A la temperatura del cero absoluto la entropía de cualquier sustancia
cristalina perfecta es cero”. Esta Ley
permite calcular la entropía absoluta de cualquier sustancia a una temperatura y presión de referencia.
Así, la entropía absoluta
estándar: SºT será la entropía de un sistema a 1 atm de presión y a la
temperatura T, calculada a partir de la
tercera Ley de la termodinámica.
Entalpia
Es una magnitud termodinámica, simbolizada con la letra H mayúscula,
cuya variación expresa una medida de la cantidad de energía absorbida o cedida
por un sistema termodinámico, es decir, la cantidad de energía que un sistema
puede intercambiar con su entorno.
En la historia de la termodinámica se han utilizado distintos términos
para denotar lo que hoy conocemos como entalpía de un sistema. Originalmente se
pensó que la palabra «entalpía» fue
creada por Emile Clapeyron y Rudolf Clausius a través de la publicación
de la relación de Clausius Clapeyron en The Mollier Steam Tables and Diagrams
de 1827, pero el primero que definió y utilizó término entalpía fue el holandés
Heike Kamerlingh Onnes, a principios del siglo XX.1
En palabras más concretas, es una función de estado de la termodinámica
donde la variación permite expresar la cantidad de calor puesto en juego
durante una transformación isobárica (es decir, a presión constante) en un
sistema termodinámico (teniendo en cuenta que todo objeto conocido puede ser entendido como un sistema
termodinámico), transformación en el curso de la cual se puede recibir o
aportar energía (por ejemplo la utilizada para un trabajo mecánico). En este
sentido la entalpía es numéricamente igual al calor intercambiado con el
ambiente exterior al sistema en cuestión.
Usualmente la entalpía se mide, dentro del Sistema Internacional de
Unidades, en joule.
El caso más típico de entalpía es la llamada entalpía termodinámica. De
ésta, cabe distinguir la función de
Gibbs, que se corresponde con la entalpía libre, mientras que la entalpía molar
es aquella que representa un mol de la sustancia constituyente del sistema.
16.
REACCIONES QUÍMICAS ENDOTÉRMICAS Y
EXOTÉRMICAS
Reacción endotérmica
Si hablamos de entalpía (H), una reacción endotérmica es
aquella que tiene un incremento de entalpía o ΔH positivo. Es decir, la energía
que poseen los productos es mayor a la de los reactivos.
Reacción exotérmica
Se denomina reacción exotérmica a cualquier reacción química que
desprenda energía, ya sea como luz
o calor,1 o lo que es lo mismo: con una variación
negativa de la entalpía; es decir: -ΔH. El prefijo exo significa
«hacia fuera». Por lo tanto se entiende que las reacciones exotérmicas liberan
energía. Considerando que A, B, C y D representen
sustancias genéricas, el esquema general de una reacción exotérmica se puede
escribir de la siguiente manera:
A + B → C + D + calor
Ocurre principalmente en las reacciones de oxidación. Cuando éstas son
intensas pueden generar fuego. Si dos átomos de hidrógeno reaccionan entre sí e integran una molécula,
el proceso es exotérmico.
H + H = H2
ΔH = -104 kcal/mol
Son cambios exotérmicos las transiciones de gas a
líquido (condensación) y de líquido a
sólido (solidificación).
Un ejemplo de reacción exotérmica es la combustión.
17.
PROCESO DE ALIMENTACIÓN. ESTRATEGIA
METABOLICA DE LOS SERES VIVOS

En el sistema digestivo ocurre una serie de procesos que modifican el alimento que ingresa al organismo. Mediante esos procesos, el alimento se transforma física y químicamente.
Los
alimentos, en su mayoría formados por moléculas complejas, se transforman o
degradan en otras más sencillas y pequeñas, condición de importancia para
su absorción.
Dentro del sistema
digestivo, la secuencia de procesos que transforman los alimentos es la
siguiente:
INGESTIÓN: proceso
de incorporación de alimentos a través de la boca.
DIGESTIÓN: serie de
procesos que ocurre en diversos órganos del sistema digestivo y que transforman
los alimentos. Comprende dos tipos de transformaciones:
- Transformación física: fragmenta
los alimentos en porciones más pequeñas a través de la masticación en la boca y
de los movimientos peristálticos a lo largo del tubo digestivo.
-
Transformación química: En la boca,
estómago e intestino delgado las enzimas digestivas desdoblan el alimento
transformándolo en moléculas más sencillas.
ABSORCIÓN: los nutrientes representados por moléculas sencillas pasan
del sistema digestivo a la sangre para ser distribuidos a todo el cuerpo.
EGESTIÓN: Es el proceso
a través del cual se expulsan los desechos de la digestión como materia fecal
hacia el exterior.
Estrategia
del metabolismo
La estrategia básica del metabolismo es
formar ATP, poder reductor y precursores para la biosíntesis. Revisemos
brevemente estos temas centrales:
El ATP es la unidad biológica universal
de energía. El elevado potencial para transferir grupos fosforillos capacita al
ATP para ser utilizado como fuente de energía en la contracción muscular,
transporte activo, amplificación de señales y biosíntesis.
El ATP se genera en la oxidación de
moléculas combustibles, como glucosa, ácidos grasos y aminoácidos. El intermediario
común en la mayoría de estas oxidaciones es el acetil-CoA. Los carbonos del
fragmento acetilo se oxidan completamente a CO2 en el ciclo del ácido cítrico,
con formación simultánea de NADH y FADH2, que transfieren sus electrones de
elevado potencial a la cadena respiratoria, con formación final de ATP. La
glucólisis es otro proceso generador de ATP, pero la cantidad que se forma es
mucho menor que en la fosforilación oxidativa (2 vrs. 30 0 32 ATP‘s). Sin
embargo, la glucólisis puede transcurrir rápidamente durante un corto tiempo en
condiciones anaeróbicas, mientras que la fosforilación oxidativa requiere del
suministro continuado de O2.
El NADPH es el principal dador de
electrones en las biosíntesis reductoras. En la mayoría de la biosíntesis, los productos
finales están más reducidos que sus precursores, y por ello, requieren, además
de ATP, un poder reductor, los cuales proceden normalmente del NADPH. La vía de
las pentosas fosfato suministra gran parte del NADPH que se necesita.
18.
AUTORREGULACIÓN EN ANIMALES
Los animales mantienen su temperatura interna sin que les afecte en ella
la temperatura ambiente, esto se produce gracias a los mecanismos de
autorregulación de la temperatura.
Este proceso de termorregulación de la temperatura permite clasificar a
los animales en dos tipos. Los homeotermos, como el hombre, los mamíferos y las
aves, son aquellos que regulan su temperatura corporal independientemente de la
temperatura del ambiente, es decir que su temperatura es constante y los
poiquilotermos, como los reptiles, son aquellos animales cuya temperatura varía
dependiendo de la temperatura ambiente.
Homeotermos (Endotermos): Se les llama animales homeotermos o de
sangre caliente a aquellos animales que tienen la capacidad de conservar su
temperatura interna, sin importar las condiciones ambientales en las que pueda
encontrarse. En esta categoría entra el grupo de las aves y los mamíferos. Esto
lo logran a través de la comida que ingieren, ya que luego de ingerirla la
convierten en energía, la que es utilizada para mantener constante su
temperatura interna y un bajo porcentaje es convertida en masa corporal, es por
esto que los animales de sangre caliente necesitan ingerir una gran cantidad de
comida.
Poiquilotermos (Ectotermos): Se les llama animales poiquilotermos o de
sangre fría a aquellos animales que no tienen
la capacidad de regular su temperatura interna por ende, estos animales
si depende de la temperatura ambiental para poder sobrevivir. Pero por otra
parte, el beneficio de estos animales es que pueden soportar diversas
variaciones que pueda experimentar la temperatura de su cuerpo sin el riesgo de
morir por hipotermia o algún tipo de enfermedades relacionadas con la
temperatura ambiental. Los animales de sangre fría obtienen el calor del medio
ambiente. En esta categoría entra el grupo de los peces, los anfibios y los
reptiles
19.
NUTRIENTES PRINCIPALES. CLASIFICACION

Son compuestos químicos contenidos en los alimentos que aportan a las células todo lo que necesitan para vivir. Ejemplos: proteínas, glúcidos, lípidos.
Los nutrientes realizan 3 tipos de
funciones en las células
Energética: aportan
energía para el funcionamiento celular. Necesitamos nutrientes energéticos para
poder hacer todas nuestras actividades. Ejemplo: para caminar o correr hay que
mover las piernas y esto se consigue cuando se contraen las células de algunos
músculos, pero para que esto ocurra las células musculares necesitan energía
que la obtienen de algunos nutrientes.
Plástica o reparadora: proporcionan los elementos materiales
necesarios para formar la estructura del organismo en el crecimiento y la
renovación del organismo. En época de crecimiento el tamaño de nuestro cuerpo
aumenta unos centímetros al año y esto solo es posible si se aporta la materia
necesaria para que las células puedan dividirse y aumentar el número de ellas
Reguladora: controlan ciertas reacciones químicas que
se producen en las células. Para que todo funcione bien en nuestro organismo
necesitamos de unos nutrientes que hacen que esto sea posible.
Tipos de nutrientes
HIDRATOS DE
CARBONO

Los Hidratos de Carbono aportan la energía necesaria diariamente para las diferentes funciones del organismo.

Los Hidratos de Carbono aportan la energía necesaria diariamente para las diferentes funciones del organismo.
El consumo de Hidratos de Carbono en
los países desarrollados es muy inferior al recomendado, además es característico
dentro de este porcentaje un excesivo consumo de carbohidratos de rápida
absorción, cuyo exceso se relaciona con un aumento del depósito graso en el
organismo y con la aparición de la caries dental. La mayoría de los
carbohidratos a incluir en la dieta deben ser de absorción lenta, ricos en
almidón como pan, pastas, arroz, legumbres, patatas...
• H de C Simples o de absorción rápida
Monosacáridos
- glucosa (uvas y cebolla)
- fructosa (azúcar de los frutos y
miel)
- galactosa (leche)
Disacáridos
- sacarosa (azúcar común)
- maltosa
- lactosa (leche y derivados lácteos)
Los lácteos y la fruta, aportan
vitaminas, minerales y fibra. Los Hidratos de Carbono simples que debemos
evitar son aquellos que no aportan más nutrientes que el propio azúcar, son los
llamados productos refinados.
•HC Complejos (polisacáridos)
Almidón
Cereales (trigo, arroz, cebada,
centeno)
Legumbres
Patata
FIBRA
Solubles (disminuyen el colesterol
sérico, aumentando la utilización de éste para la síntesis e ácidos biliares)
Insoluble (aumentan la motilidad
intestinal, aumentan el volumen fecal)
La fibra es una sustancia no digerible
y a calórica. Se encuentra en las paredes de las células vegetales: frutas,
verduras y hortalizas, cereales integrales, legumbres, variando su composición
y contenido en función del vegetal.
Funciones: regulación de la motilidad
intestinal, saciedad, eliminación de colesterol y sales biliares. Se recomienda
consumir unos 25-30 gr/día.
PROTEÍNAS

Son macromoléculas constituidas a partir de aminoácidos.

Son macromoléculas constituidas a partir de aminoácidos.
Desempeñan múltiples funciones:
transporte, plásticas o estructurales, de reserva, catalíticas, reguladoras y
defensivas. Las proteínas son, junto a las grasas y los azúcares simples,
nutrientes que se consumen en exceso en los países desarrollados, por lo tanto
la recomendación general es reducir su consumo.
• Proteínas animales (carnes, pescados
y huevos)
Son ricas en aminoácidos esenciales. La
ingesta de proteínas animales suele estar relacionado con un mayor consumo de
grasas saturadas y colesterol. Se recomienda optar por carnes magras. Los
pescados tienen prácticamente el mismo contenido proteico que las carnes, con
la particularidad de que su grasa (ácidos grasos omega3) presenta efectos
beneficiosos preventivos frente a la enfermedad cardiovascular.
• Proteínas vegetales (legumbres,
cereales)
Se caracterizan por ser pobres en
grasas saturadas y colesterol. Las proteínas de origen vegetal suelen ser
incompletas, ya que tanto las legumbres como los cereales son deficientes en
algún aminoácido. Los cereales son pobres en lisina y las leguminosas en
aminoácidos azufrados. En dietas vegetarianas se recomienda mezclar en el mismo
palto cereales y legumbres con el fin de obtener un aporte proteico completo.
GRASAS

La cantidad y calidad de la grasa consumida afecta decisivamente a nuestro organismo. En general, los países desarrollados presentan un consumo de grasa superior al recomendado, este hecho queda reflejado en el aumento de obesidad y enfermedades desencadenantes de los últimos años.

La cantidad y calidad de la grasa consumida afecta decisivamente a nuestro organismo. En general, los países desarrollados presentan un consumo de grasa superior al recomendado, este hecho queda reflejado en el aumento de obesidad y enfermedades desencadenantes de los últimos años.
Funciones
Protección del esqueleto y órganos
vitales
Aislamiento térmico, ayuda a mantener
la temperatura corporal.
Reserva energética.
Los diferentes ácidos grasos se dividen
según su grado de saturación:
MONOINSATURADOS
El ácido graso mono insaturado por excelencia
es el ácido Oleico, componente abundante en el aceite de oliva. El ácido oleico
es beneficioso por el papel que ejerce sobre el colesterol y las lipoproteínas
que lo contienen. Una dieta rica en ácidos grasos mono insaturados, un poco
menor en poliinsaturados y pobre en saturados ayudan a disminuir el colesterol
LDL (lipoproteínas de baja densidad) y a aumentar el HDL (lipoproteínas e alta
densidad).
SATURADOS
Los ácidos grasos se caracterizan
porque no presentan dobles enlaces en su estructura. Se encuentra en alimentos
procedentes de animales terrestres (carnes y derivados, leche entera y
semidesnatada, mantequilla) y en los aceites de coco y palma.
POLIINSATURADOS
El más abundante es el ácido linoleico
(18:2 n=6). Se encuentran generalmente en aceites e semillas (girasol, maíz,
germen de trigo, pepita de uva, cacahuetes...)
ÁCIDOS GRASOS POLIINSATURADOS omega3
Se encuentran prácticamente de forma
exclusiva en el pescado azul. Los pescados blancos no contienen este tipo de
ácido debido a que no contienen fracción grasa. Existe relación entre el tipo
de grasa consumida y una menor incidencia de muertes por accidentes
cerebrovasculares. Según diferentes estudios, las poblaciones que tenían un
mayor consumo de pescado (esquimal y japonés) presentaban una incidencia de
muertes por enfermedades cardiovasculares más baja. Los ác. grasos omega3 dan
lugar a eicosanoides, los cuales presentan actividad vasodilatadora y
antiagregante, disminuyendo por tanto la probabilidad de formación de trombo o
coágulos. Se ha de destacar que en países del mediterráneo como España y
Portugal, existe una menor incidencia de enfermedad cardiovascular en
comparación con otros países occidentales.
ÁCIDOS GRASOS TRANS
Son resultado de la hidrogenación de
los aceites vegetales para formar productos más sólidos, este proceso convierte
las grasas en productos muy perjudiciales para la salud, incluso con un efecto
más nocivo que las grasas saturadas en lo que refiere a enfermedades
cardiovasculares."
Margarinas: son productos obtenidos
industrialmente a partir de aceites vegetales o de pescado por hidrogenación.
La saturación parcial de estos aceites confiere una consistencia semisólida. El
proceso es complejo y consiste en un "endurecimiento de las grasa".
La composición del alimento es variable
dependiendo tanto del producto de partida como del proceso de hidrogenación.
Durante el proceso existe pérdida de ácidos grasos esenciales y se forman
dobles enlaces "trans". Actualmente, diversas marcas de margarina,
han mejorado el proceso de elaboración de este tipo de productos con el fin de
evitar la aparición de grasas trans.
COLESTEROL
Se recomienda no superar los 300 mg/día
Alimentos ricos en colesterol:
vísceras, yema de huevo, mariscos...
Funciones- Forma parte de las membranas
y es un precursor de hormonas, ácidos Biliares y vitamina D.
Un exceso de colesterol influye de
forma negativa en el organismo pudiendo dar lugar a la aparición de patologías
coronarias. El colesterol puede sintetizarse en el organismo a partir de otras
moléculas. Además, el colesterol sanguíneo no depende únicamente de la cantidad
de colesterol alimentario sino que existen otros factores más determinantes,
como la presencia de lipoproteínas transportadoras HDL (alta densidad) y LDL
(baja densidad), las cuales se encuentran en una proporción adecuada al perfil
de grasas (calidad y cantidad) consumidas en la dieta habitual. Estas
lipoproteínas ejercen un papel determinante en el índice de colesterol
plasmático.
La densidad de las lipoproteínas
aumenta conforme lo hace el perfil proteico y disminuye la cantidad de
triglicéridos y el tamaño. Por ello las lipoproteínas HDL (lipoproteínas de
alta densidad) son las clasificadas como colesterol bueno.
VITAMINAS

Compuestos orgánicos vitales para el
correcto funcionamiento del organismo. Deben estar presentes en la dieta, ya
que el organismo no es incapaz de sintetizarlas en cantidad suficiente.
VITAMINAS LIPOSOLUBLES

VITAMINA A
- Funciones principales: interviene en
el mecanismo de visión, huesos y dientes y desarrollo nervioso.
- Fuentes: aceite de hígado de pescado,
yema de huevo, hígado, productos lácteos, margarina y mantequilla.
El beta-caroteno (provitamina A) se
encuentra en frutas y verduras de color amarillo, anaranjado y verde oscuro
(zanahorias, espinacas, melón, albaricoques, brócoli...)
VITAMINA D
- Funciones principales: metabolismo
huesos, homeostasis calcio. - Fuentes: hígado, huevos, pescado. Exposición a la
luz solar.
VITAMINA K
- Funciones principales: coagulación de
la sangre, interviene en el mecanismo de mineralización ósea.
- Fuentes: col, coliflor, brócoli,
espinacas, lechuga, calabaza, pescado, huevos, cereales...
VITAMINA E
- Funciones principales: antioxidante
de las membranas, anticoagulante, antagonista de la Vitamina K, interviene en
los sistemas muscular, vascular, reproductivo y nervioso central.
- Fuentes: aceites vegetales, nueces,
vegetales de hoja verde, aguacate.
VITAMINAS
HIDROSOLUBLES:

• Tiamina (Vitamina B 1): cereales integrales, levadura, carne y
nueces.
• Riboflavina (Vitamina B 2): huevo, leche, carne (hígado),
verduras.
• Niacina (Vitamina B 3): cereales, verduras, hígado y carne.
• Ácido pantoténico (vit. B 5): alimentos de origen animal, cereales
enteros y legumbres.
• Vitamina B 6 (Piridoxamina): vísceras, huevo, maíz, arroz,
verduras.
• Biotina (vitamina B 8): yema de huevo, arroz, soja, vísceras.
• Ácido
Fólico: vegetales de hoja verde, hígado.
• Vitamina B
12 (cobalamina, cianocobalamina): vísceras, huevo, leche, pescado.
• Vitamina C: cítricos,
patatas y verduras.
Si nuestra alimentación es variada y
por lo tanto incluye todo tipo de alimentos, nuestro aporte de vitaminas y
minerales será correcto.
MINERALES

Compuestos inorgánicos con funciones
relevantes en los diferentes mecanismos del organismo. Podemos dividirlos en
macrominerales, aquellos que necesitan un aporte mínimo de 100 mg/día y
oligoelementos.
Los minerales que necesitamos aportar
en mayor proporción son los siguientes: Ca, P, Mg, K, Na, Cl, S
Calcio
Funciones: formación de huesos y dietes
fuertes, contracción muscular, ritmo cardiaco, irritabilidad nerviosa...
Fuentes: productos lácteos, frutos
secos, vegetales e hoja verde, salmón y sardinas (con espina).
Fósforo
Está presente en el cuerpo humano en un
80% en esqueleto y dientes y en un 20% en liquido extracelular y células.
Funciones: interviene en el metabolismo
de obtención de energía (ADP, ATP), metabolismo de las grasas, aminoácidos e
Hidratos de Carbono, contribuye a la regulación del calcio, por lo tanto es
importante para huesos y dientes.
Fuentes: carne, pescado, yemas de
huevo, nueces, productos lácteos.
Potasio
Principal ion intracelular
Funciones: conducción nerviosa,
contracción muscular, síntesis y uso de proteínas, equilibrio ácido-base.
Fuentes: frutas y verduras, leche.
Sodio
Principal ion extracelular junto al Cl.
Funciones: estimulación nerviosa,
contracción muscular, equilibrio ácido-base, regulación de la presión sanguínea
y transporte de glucosa a las células.
Fuentes: leche, quesos, huevos, carne,
pescado, zanahorias, apio, espinacas, acelgas, sal de mesa. Los alimentos
procesados suelen contener cantidades significativas de sal.
Cloro
Principal ion extracelular junto al
sodio.
Funciones: equilibrio ácido-base,
digestión (HCl), intercambio de O 2 /CO 2 en glóbulos rojos, equilibrio de
líquidos.
Fuentes: sal de mesa, alimentos
procesados, aceitunas verdes.
Magnesio
Funciones: Necesario para múltiples
reacciones bioquímicas del cuerpo; ayuda a la contracción muscular; transmisión
de impulsos nerviosos; sistema cardiaco; metabolismo de la energía y síntesis
de proteínas; prevención ateroesclerosis; bombeo de Na/K.
Fuentes: vegetales de hoja verde
(espinacas), nueces, semillas, granos enteros (trigo, salvado)
Azufre
Funciones: forma parte de algunos
aminoácidos, de la queratina de la piel, uñas y pelo.
Fuentes: carnes, pescados, huevos y
legumbres.
OTROS MINERALES DE IMPORTANCIA
Hierro
El hierro es el elemento traza más
abundante en el organismo.
Funciones: transporte de oxígeno;
participa en los mecanismos de obtención de energía (ADP-ATP).
Fuentes: Los alimentos más ricos en
hierro son las carnes, en especial el hígado. Las legumbres, frutos secos y
verduras foliáceas contienen hierro "no hemo", por lo que su
absorción resulta menor.
Yodo
Componente esencial de las hormonas
tiroideas.
Fuentes: los alimentos de origen marino
son muy ricos en yodo. También lo contienen verduras, carnes y huevos. Además
la utilización de sal de mesa yodada es una buena opción en casos de
deficiencia.
Flúor
Se encuentra en el organismo en
cantidades similares al hierro.
Funciones: está presente en los huesos
(fluoropatita) y en los dientes en menor proporción.
• Conserva la dureza del esmalte de los
dientes.
• Contribuye a mantener la matriz
mineral ósea
Fuentes: agua (a mayor dureza de ésta
más rica en minerales. También se encuentra en pescados y té negro)
Existen otros minerales de menor importancia
tales como: cinc, cobre, selenio, cromo, manganeso, molibdeno... Una dieta sana
y equilibrada, en la que se incluyan todos los grupos de alimentos, debe
aportar como norma general todos los nutrientes que nuestro organismo necesita.
20.
EVAPORACIÓN. SUDOR
Mediante la evaporación del sudor se pierde 22% del calor corporal, una
corriente de aire que reemplace al aire húmedo por el aire seco aumenta la
evaporación.
La evaporación del H2O en el organismo ocurre por los siguientes
mecanismos:
Evaporación insensible o perspiracion: es aquella que se realiza en todo
momento y atreves de los poros de la piel.
Evaporación superficial: es la formación del sudor por medio de las
glándulas sudoríparas presentes en todo el cuerpo pero en especial en la
frente, palma de las manos, axilas, pies y zona púbica.
Sudor

sensación de calor en nuestro cuerpo se manifiesta por la producción
de sudor. El sudor es una secreción que se produce en las glándulas exocrinas
distribuidas por todo el cuerpo que desembocan en los poros de la piel. El
sudor se mezcla en la superficie de la piel con el sebo o grasa procedente de
las glándulas sebáceas para dar lugar al manto hidrolipídico o emulsión
epicutánea, responsable del buen funcionamiento y suavidad de la piel, así como
del mantenimiento de una temperatura corporal constante, evitando una posible
deshidratación. Por otro lado, popularmente se considera que a través del sudor
el organismo puede eliminar muchas toxinas, así como algunas sustancias
medicamentosas.
En la composición del sudor encontramos básicamente agua en un 95% y una
serie de sustancias, electrolitos que constituyen el factor de hidratación
natural (FHN) responsable de la hidratación cutánea. Además, en el sudor
también encontramos ácido urocánico, que es un filtro natural que ayuda a
protegernos de la radiación solar.


No hay comentarios.:
Publicar un comentario